Slik utvikles og godkjennes legemidler
Publisert:
|
Oppdatert:
Endringer
- : Inkludert informasjon om godkjenning av legemidler - endret tittel
Innhold på siden
Om utvikling av legemidler
Nye legemidler kan komme fra grunnforskning, være basert på en innovativ idé, eller være resultat av forskning i industrielle miljøer. Utviklingsprogrammet strekker seg over flere år og må skje i samsvar med internasjonalt og nasjonalt regelverk.
Et viktig prinsipp ved gjennomføring av kliniske utprøvinger er etisk forsvarlighet og beskyttelse av forsøkspersonene. Dette har sin opprinnelse i Helsinkideklarasjonen, og er stadfestet i retningslinjene for god klinisk forskningspraksis, ICH-GCP.
Klinisk utprøving av legemidler utføres for å skaffe til veie informasjon som til syvende og sist kan forbedre tilgangen til trygge og effektive legemidler til pasienter, samtidig som forsøkspersonene i studien er beskyttet.
- Les mer om klinisk utprøving av legemidler til mennesker
- Les mer om klinisk utprøving av legemidler til dyr
- Les mer om generelle prinsipper for utvikling av legemidler: "ICH guideline E8 (R1) on general considerations for clinical studies"
Faser i legemiddelutvikling
Legemidler til mennesker
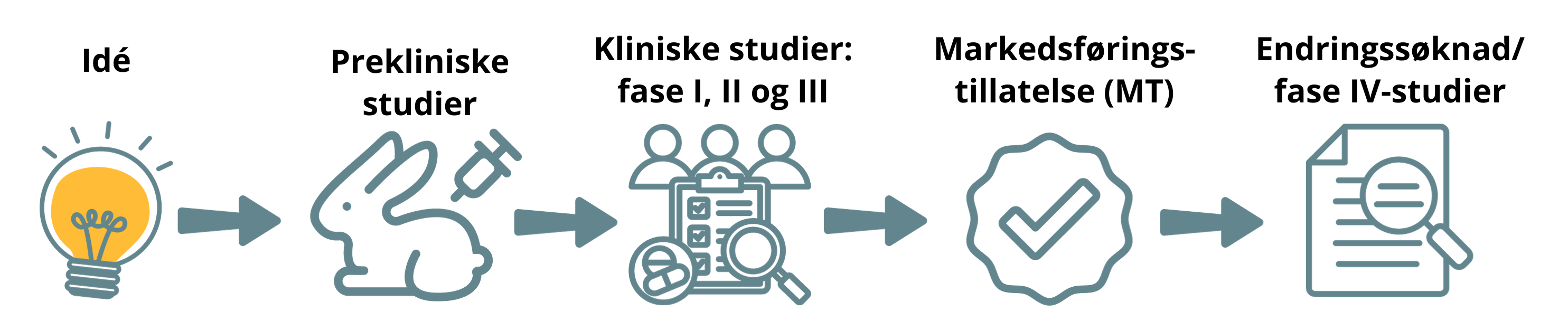
Prekliniske studier
Før legemidlet prøves ut i mennesker, skal det gjøres mange forskjellige prekliniske studier. Dette er både in vitro-studier (studier utenfor en levende organisme – prøveglass) og in vivo-studier (dyrestudier). I dyrestudiene brukes det forskjellige dyrearter, og her undersøkes både preliminær effekt, toksisitet og farmakokinetikk.
Det utarbeides gjerne en klinisk utprøvningsplan for videre uttesting i mennesker når prekliniske studier viser at et nytt legemiddel ser ut til å kunne være effektivt og sikkert og det er bekreftet at det foreligger et medisinsk behov. Denne planen utarbeides sentralt i firmaet, eller i en forskningsgruppe I de senere år er det blitt mer og mer vanlig å innhente vitenskapelige råd ("scientific advice") fra legemiddelmyndigheter.
Kliniske studier
Positive resultater (positivt risiko/nytte-forhold) fra et adekvat oppbygd klinisk studieprogram (klinisk fase I, II og III-studier) av høy vitenskapelig kvalitet er helt avgjørende for at et nytt legemiddel skal kunne få markedsføringstillatelse og bli gjort tilgjengelig for pasienter. I noen tilfeller vil det også være nødvendig å gjøre ytterligere kliniske studier (klinisk fase IV) etter at legemidlet er kommet på markedet. De forskjellige fasene kan forstås på denne måten:
Fase 1: Humanfarmakologiske studier
Dette er første dose til mennesker, enten friske frivillige, eller til pasienter som har den aktuelle sykdommen. Behandlingen gis i et kort tidsrom og dose-toleranse, farmakokinetikk og farmakodynamikk undersøkes.
Fase 2: Terapeutisk eksplorative studier
Her undersøkes terapeutisk effekt hos et mindre antall pasienter. Det er korte dosefinnende studier med veldefinerte pasientgrupper. Det er ofte surrogatendepunkter i studien.
Fase 3: Terapeutisk bekreftende studier
Dette er større kontrollerte studier på effekt og sikkerhet i den aktuelle pasientgruppen. Studiene kan ha harde endepunkter og undersøker ofte dose-respons og, så langt det er mulig, bivirkningsmønster og frekvens. Det sammenlignes ofte med etablert behandling. Når fase 3 er avsluttet, har man som regel tilstrekkelig dokumentasjon til å kunne søke om markedsføringstillatelse (godkjenning) for legemidlet. Fase 3-studier kan også være studier på allerede godkjente legemidler, men på en ny indikasjon.
Fase 4: Terapeutisk bruk
Slike studier kalles ofte "real life studier". Studiene gjelder legemidler som har markedsføringstillatelse, innenfor rammen av godkjent produktinformasjon (SmPC). Hensikten med disse studien kan være å samle ytterligere informasjon om effekt, mortalitet, morbiditet, eller nye endepunkter. Hensikten kan også være å studere helseøkonomiske aspekter.
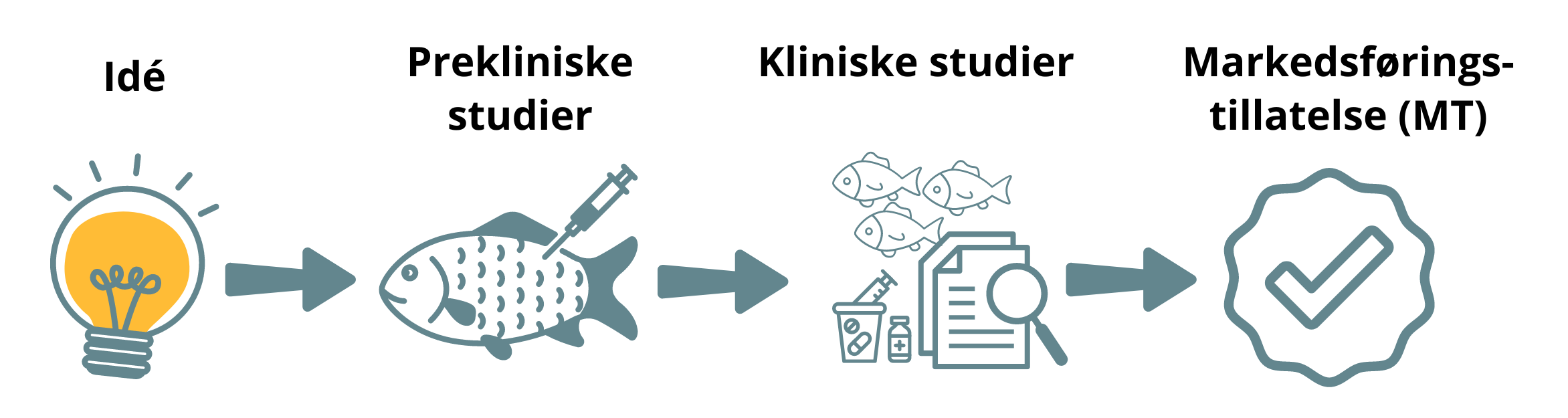
Legemidler til dyr
Veiledning og råd til bedrifter og akademia
DMP bistår bedrifter og akademia med veiledning og råd innenfor utvikling av medisinske produkter, klinisk utprøving og helseøkonomi. DMP veileder også apotek, grossister og tilvirkere på legemiddelområdet.
Les mer
Om godkjenning av legemidler
Godkjenning av et legemiddel innebærer at produsenten får markedsføringstillatelse (MT), det vil si tillatelse til å selge legemiddelet. Godkjenning skjer i all hovedsak gjennom det europeiske samarbeidet. Norge er del av dette gjennom EØS-avtalen.
Et legemiddel blir bare godkjent for salg dersom legemiddelet har en nytte som overstiger risikoen ved bruk. Vurdering av nytte-/risikoforholdet til et legemiddel er basert på dokumentasjon som produsenten må sende inn når de søker om markedsføringstillatelse. I søknaden må produsenten dokumentere legemidlets farmasøytiske kvalitet, sikkerhet og medisinske effekt.
Prosedyrer for godkjenning
Når produsenten skal sende inn en søknad om markedsføringstillatelse (MT) kan dette skje gjennom fire ulike prosedyrer.
Forskjellige statuser for et legemiddel
I utgangspunktet skal alle legemidler som brukes i Norge være godkjent av DMP, slik at produsenten får markedsføringstillatelse (MT) for legemidlet. Likevel kan legemidler med ulike statuser være i bruk – av ulike årsaker.
Generisk og parallellimportert legemiddel
Det første godkjente legemidlet med et nytt aktivt virkestoff kalles originallegemiddel. Når patenttiden går ut kan det utvikles kopier, såkalte generiske legemiddel.
Parallellimporterte legemidler er originallegemidler importert fra andre europeiske land der prisene er lavere enn i Norge.
Når blir et legemiddel tilgjengelig for bruk?
Når et legemiddel har fått markedsføringstillatelse (MT) og dermed er godkjent, kan legemiddelet markedsføres - settes på markedet. Dette er opp til selskapene om et legemiddel blir markedsført, og mange legemidler blir ikke markedsført i Norge.
Hvis et legemiddel skal betales av det offentlige, må myndighetene gjøre en kost/nytte-vurdering før det tas en beslutning om bruk.
