Utvikling av medisinske produkter
Publisert:
|
Oppdatert:
Endringer
DMP tilbyr veiledning og råd om utvikling av humane og veterinære legemidler og medisinsk utstyr.
Innhold på siden
Kontaktskjema
Om tjenesten
Veiledning og råd skal gi brukerne:
-
forståelse av veien fra idé til godkjent produkt.
-
tilgang på ekspertise med erfaring fra utredning av søknader.
-
mulighet til å diskutere en søknad før den sendes inn, slik at dokumentasjonen er i henhold til regulatoriske krav.
-
råd om hvordan gjennomføre studier for at de skal kunne gi tolkbare resultater første gang studiene gjennomføres. På den måten sparer bedrifter og samfunnet tid og ressurser.
Les mer om utvikling og godkjenning av legemidler
Hva kan DMP tilby?
Vi kan gi råd og veiledning i alle faser av legemiddelets livsløp på bakgrunn av vår generelle vitenskapelige og regulatoriske ekspertise. For medisinsk utstyr tilbyr vi regulatorisk veiledning. Ekspertisen har vi opparbeidet oss gjennom utredning av søknader i både nasjonale og europeiske prosedyrer.
I det europeiske samarbeidet har Norge de samme rettighetene og pliktene som de øvrige legemiddelmyndighetene. DMP bidrar aktivt i utredning og regelverksutvikling gjennom deltagelse i europeiske arbeidsgrupper og vitenskapelige komiteer.
På hvilke områder har vi særskilt ekspertise?
Innenfor det europeiske samarbeidet har DMP opparbeidet særskilt ekspertise innen våre satsningsområder:
Legemidler til mennesker:
-
Profylaktiske vaksiner
-
Kreft (Solide svulster)
-
Antibiotika
Legemidler til dyr:
-
Fisk (vaksiner og kjemiske/syntetiske virkestoffer)
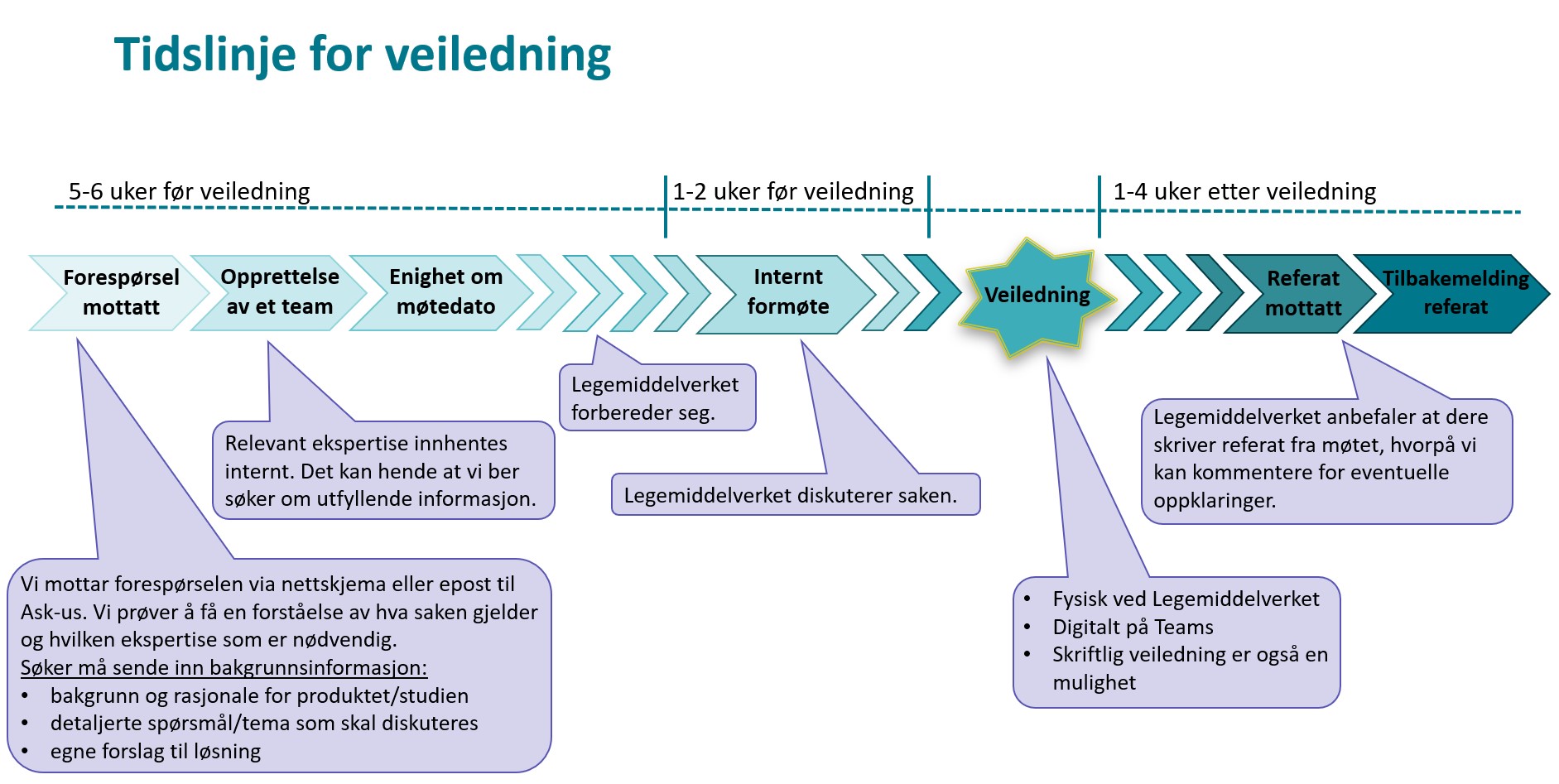
Rutiner og tidslinje for veiledning
- Fyll ut nettskjema for forespørsel om vitenskapelig/regulatorisk veiledning. Send eventuelt en epost til Ask-us@dmp.no. Last gjerne opp en detaljert beskrivelse av problemstillingene slik at vi får en forståelse av hva saken gjelder og hvilken ekspertise som er nødvendig. Bakgrunnsinformasjonen bør som et minimum inneholde:
- Bakgrunn og rasjonale for produktet/studien
- De detaljerte spørsmål/tema som skal diskuteres
- Egne forslag til løsning
- DMP oppretter et team og blir enig med søker om møtedato cirka 5 uker frem i tid. Det kan hende vi ber om utfyllende informasjon. Vi gjør oppmerksom på at jo bedre problemstillingen er beskrevet, desto bedre svar eller anbefaling kan vi gi. Bruk gjerne EMAs mal for scientific advice. Det kan også lages en forenklet versjon med relevant informasjon i henhold til kulepunktene over. Dersom du har kjennskap til at legemiddelet tidligere har vært gjennom en rådgivningsprosess hos andre legemiddelmyndigheter, skal innholdet av dette gjengis.
- Det vil normalt ikke være rom for diskusjon av andre problemstillinger enn de som er sendt til oss i forkant.
- 1-2 uker før veiledningsmøtet holdes et internt formøte hvor DMP diskuterer saken.
- Selve veiledningsmøtet kan være fysisk ved DMPs kontorer eller digitalt på Teams. Møtets varighet er maksimalt 90 minutter med mindre det er avtalt at det aktuelle temaet krever mer tid. Skriftlig veiledning er også en mulighet.
- DMP lager ikke referat fra veiledningsmøter. Vi mottar imidlertid gjerne søkers møtereferat til kommentering og avklaring av eventuelle misforståelser.
- Merk at rådene vi gir er basert på nåværende kunnskap/forståelse av spørsmålet og gjeldende regelverk og retningslinjer. Rådene og informasjonen er ikke bindende, verken for Direktoratet for medisinske produkter eller for de som har bedt om råd.
EMA tilbyr også scientific advice
Det Europeiske legemiddelkontoret (EMA, European Medicines Agency) tilbyr vitenskapelig rådgivning til bedrifter i forbindelse med legemiddelutvikling (Scientific advice). Merk at EMA ikke tilbyr vitenskapelig råd til akademiske miljøer. Nasjonal vitenskapelig/regulatorisk veiledning er ment som et raskere og mer tilgjengelig supplement til EMAs vitenskapelige veiledning og et tilbud til akademia.
Vi gjør også oppmerksom på at EMA har etablert eget kontor for små og mellomstore bedrifter (SME office). Slike bedrifter kan søke om SME-status som gir en rekke fordeler, blant annet sterkt reduserte avgifter for vitenskapelig rådgivning i regi av EMA. Se mer informasjon angående EMAs rådgiving.
Samtidig nasjonal veiledning fra to europeiske myndigheter
DMP deltar i en europeisk pilot som skal teste ut «simultaneously national scientific advice (SNSA)», ved nasjonal vitenskapelig og regulatorisk veiledning for kliniske studier og legemiddelutvikling.
SNSA går ut på at den som søker veiledning på samme problemstilling i to av landene som deltar i piloten, ber de to landene om å samarbeide om en felles uttalelse. Veiledningen kan være omforent eller eksponere divergerende syn i de to aktuelle myndighetene.
Den første piloten for SNSA ble lansert i februar 2020. Vi er nå i gang med pilot 2. I sammenheng med ACT-EU initiativet, så vil denne piloten ha et spesifikt fokus på veiledning for å tilrettelegge for kliniske utprøvinger i Europa.
Forespørsel om samtidig nasjonal veiledning fra to europeiske myndigheter rettes til Direktoratet for medisinske produkter og sendes til ask-us@dmp.no.
For mer informasjon om ordningen, se nettsidene til EMA og kunngjøring fra SNSA.